研究実施中の申請
変更申請・実施状況報告・SAE報告・終了報告・緊急回避逸脱報告
倫理審査システムより申請してください。
/
研究変更申請
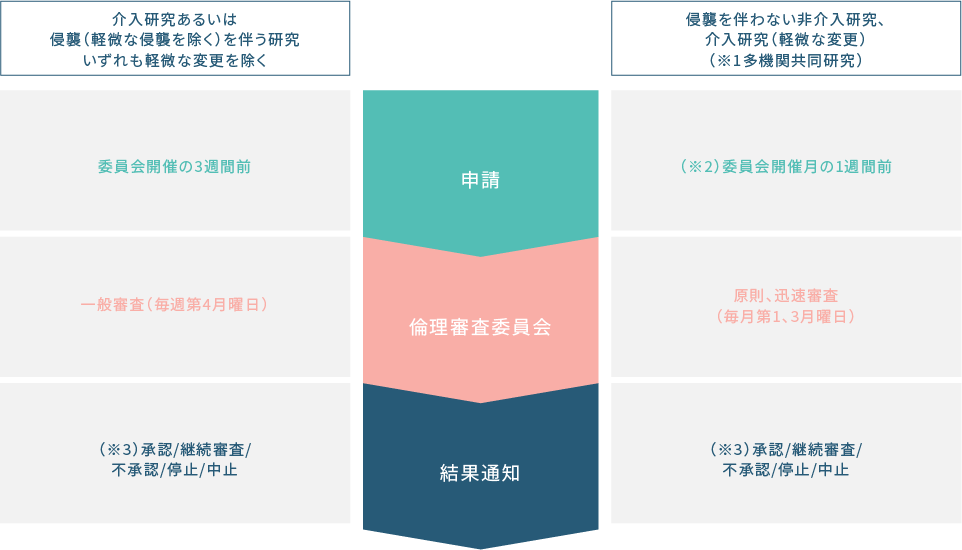
(※1)多施設共同研究のうち他機関が研究代表である臨床研究が対象です。
(※2)最終版の申請に不備がございます場合、審査可能な委員会が翌月以降となる可能性がございます。
(※3)修正した上で承認、保留の場合は、承認となるまで研究の開始はできません。
提出資料
- 研究に関する変更申請書(倫理審査システムで作成)
- 変更する審議資料(計画書・説明文書・同意書など)
/
研究実施状況報告(年1回)
提出資料
- 研究等実施状況報告書
重篤な有害事象が発生した場合
提出資料
※「自主臨床研究における重篤な有害事象及び不具合発生時の手順書」を参照してください
第1報(事象発生後、速やかに)報告時
- 「重篤な有害事象1」
- 「安全性情報等に関する報告書」
第2報(原則7日以内)報告時
- 「重篤な有害事象1」
- 「重篤な有害事象2」
- 「安全性情報等に関する報告書」
緊急回避のための研究計画書からの逸脱報告
提出資料
- 「緊急の危険を回避するための研究計画書からの逸脱に関する報告書」
研究を終了・中止・中断する場合
提出資料
- 「研究終了(中止・中断)報告書」
