新規申請時フロー
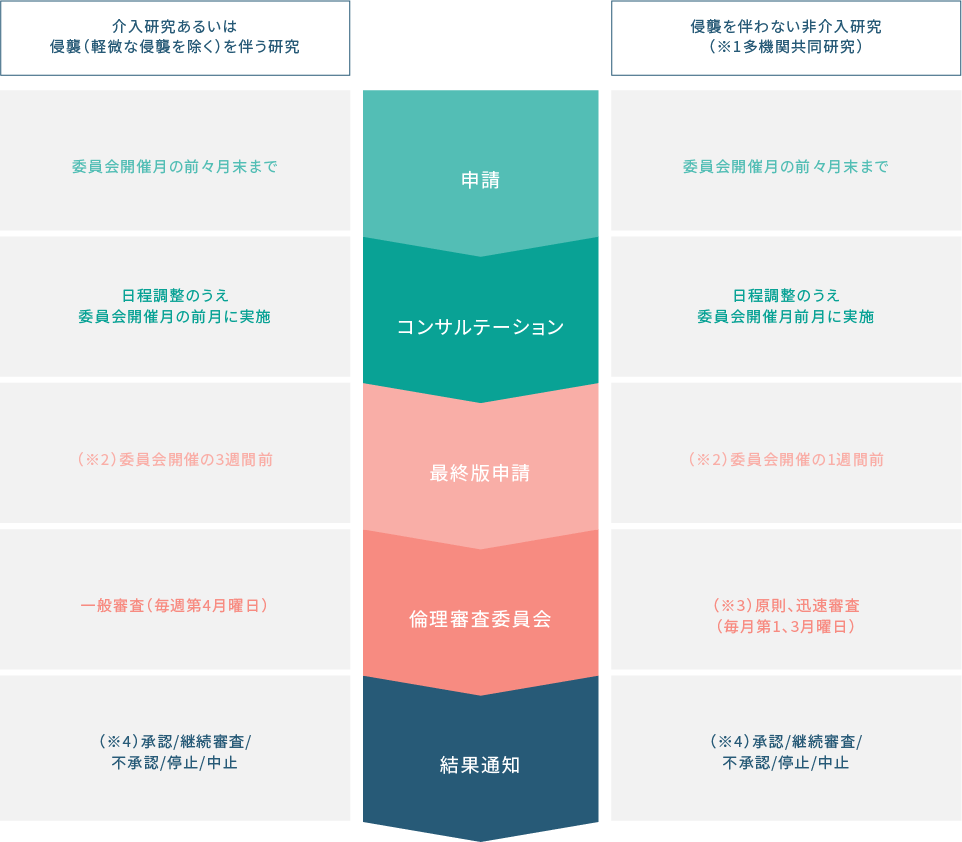
(※1)多施設共同研究のうち他機関が研究代表である臨床研究が対象です。
(※2)最終版の申請に不備がある場合、審査可能な委員会が翌月以降となる可能性がございます。
(※3)倫理審査委員会が必要と判断した場合は、毎月第4月曜日の一般審査で審議されることもございます。
(※4)修正した上で承認、保留の場合は、承認となるまで研究の開始はできません。
/
多機関共同研究(代表) 一括審査フロー
研究代表者は審査結果、審査過程のわかる記録等を共同研究機関の研究責任者に共有し、各研究機関の研究責任者はそれをもって当該研究機関の長に研究の実施の許可を受ける。
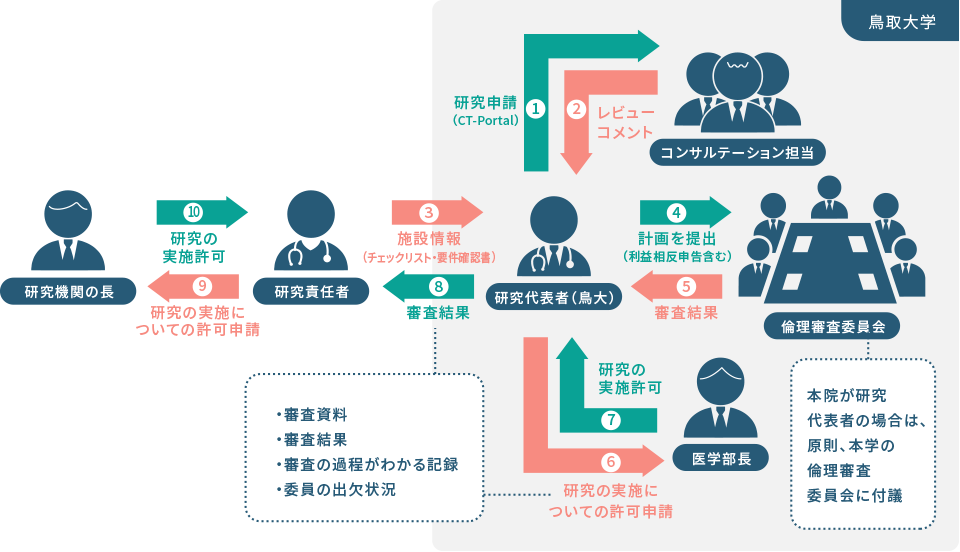
手順書がない場合は、要作成
多機関共同研究は、一つの研究計画書、一つの同意説明文書様式で実施するため、各医療機関個別の資料の作成は不可
/
本学での一括審査申請
倫理審査申請書類(CT-Portal)
- 審査依頼書研究計画書
- 同意説明文書(その他、研究に必要な資料)
- 一括審査依頼書:他施設の実施体制に関する情報
- 要件確認書(チェックリスト):各実施機関の実施体制、手順書の有無、COIの状況を確認し、一括審査依頼書とともに提出
/
多機関共同研究(分担) 一括審査フロー

※研究対象者の疾病の診断・治療・予防に用いることを目的としない検査を実施する場合は観察(非介入)研究
※通常診療で得られた検査結果(画像所見、血液検査等)を前向きに収集する場合は観察研究(侵襲なし、非介入)
※研究目的の採血量は、1回30mLを目安に侵襲の有無を判断(通常診療に付随する場合は、総採血量も考慮)
